- Forfatter Jason Gerald gerald@how-what-advice.com.
- Public 2023-12-16 11:30.
- Sist endret 2025-01-23 12:42.
Fortynning er prosessen med å gjøre en konsentrert løsning mer fortynnet. Det er en rekke årsaker til at noen kanskje vil gjøre en fortynning, alt fra alvorlige til enkle årsaker. For eksempel fortynner biokjemikere løsninger fra sine konsentrerte former for å lage nye løsninger for bruk i eksperimenter, mens bartendere derimot ofte fortynner brennevin med brus eller juice for å gjøre cocktailer bedre. Den generelle formelen for beregning av fortynning er C1V1 = C2V2, med C.1 og C2 representerer henholdsvis den første og siste konsentrasjonen av løsningen og V1 og V.2 representerer volumet.
Steg
Metode 1 av 2: Konsentrater av fortynning nøyaktig via fortynningsligningen

Trinn 1. Bestem hva du vet og ikke vet
Fortynning i kjemi betyr vanligvis å ta en liten mengde av en løsning som du kjenner konsentrasjonen av, og deretter tilsette en nøytral væske (for eksempel vann) for å lage en ny løsning med et større volum, men lavere konsentrasjon. Dette gjøres veldig ofte i kjemilaboratorier, fordi reagensene for effektivitetens skyld ofte lagres i svært høye konsentrasjoner, som deretter fortynnes for bruk i eksperimenter. Vanligvis vil du i de fleste virkelige situasjoner vite konsentrasjonen av den opprinnelige løsningen og konsentrasjonen eller volumet du vil at den endelige konsentrasjonen skal være, men ikke volumet av den opprinnelige løsningen du trenger for å få den endelige løsningen.
- I andre situasjoner (spesielt i skoleproblemer) kan det imidlertid hende du må finne andre brikker i puslespillet - for eksempel kan du få et innledende volum og konsentrasjon, og deretter bli bedt om å finne den endelige konsentrasjonen hvis du fortynner en løsning. til ønsket volum. I alle tilfeller av fortynning er det nyttig å merke seg de kjente og ukjente variablene før du starter.
-
La oss avslutte eksempelspørsmålene. Anta at vi blir bedt om å fortynne en 5 M løsning med vann for å lage 1 L av en 1. løsning mM. I dette tilfellet kjenner vi konsentrasjonen av vår opprinnelige løsning og volumet og sluttkonsentrasjonen vi ønsker, men ikke mengden av den opprinnelige løsningen vi må tilsette med vann for å oppnå ønsket resultat.
Påminnelse: I kjemi er M en måling av konsentrasjon kalt Molarity, som angir molene til et stoff per liter
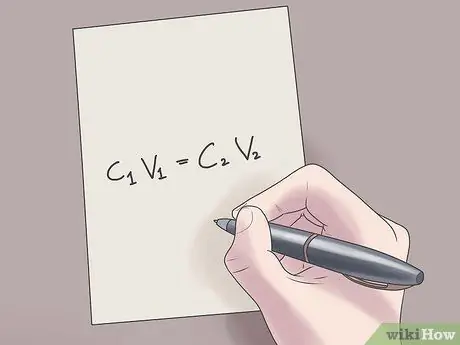
Trinn 2. Koble verdiene til formelen C1V1 = C2V2.
I denne formelen, C1 er den opprinnelige konsentrasjonen av løsningen, V1 er volumet av den opprinnelige løsningen, C2 er den endelige konsentrasjonen av løsningen, og V2 er volumet på den endelige løsningen. Å koble kjente verdier til denne ligningen vil hjelpe deg med å finne ukjente verdier med mindre vanskeligheter.
- Det kan være nyttig å sette et spørsmålstegn foran enheten du vil søke etter for å hjelpe deg med å løse det.
-
La oss fortsette vårt eksempel. Vi skriver inn verdiene vi kjenner som følger:
- C1V1 = C2V2
- (5 M) V1 = (1 mM) (1 L). Våre to konsentrasjoner har forskjellige enheter. La oss stoppe her og gå videre til neste trinn.

Trinn 3. Vurder eventuelle enhetsforskjeller
Siden løsninger innebærer endringer i konsentrasjon (som noen ganger kan være ganske store), er det ikke uvanlig at de to variablene i ligningen din har forskjellige enheter. Selv om dette er lett å overse, kan ulike enheter i ligningen føre til at svaret ditt er feil. Før du fullfører, konverter alle verdier med forskjellige konsentrasjons- og/eller volumenheter.
-
I vårt eksempel bruker vi forskjellige enheter for konsentrasjoner av M (molarer) og mM (millimolarer). La oss endre vår andre måling til M:
- 1 mM × 1 M/1.000 mM
- = 0,001 M

Trinn 4. Fullfør
Når alle enhetene er like, løser du ligningen. Dette kan nesten alltid gjøres med enkel algebra.
-
Vi stopper vårt eksempelproblem her: (5 M) V1 = (1 mM) (1 L). La oss finne verdien av V1 med vår nye enhet.
- (5 M) V1 = (0,001 M) (1 L)
- V1 = (0,001 M) (1 L)/(5 M).
-
V1 = 0,0002 L eller 0,2 ml.

Trinn 5. Forstå hvordan du bruker svaret ditt riktig
La oss si at du har funnet din manglende verdi, men du er ikke sikker på hvordan du skal bruke denne nye informasjonen i selve fortynningen du må gjøre. Dette er forståelig - matematikk- og vitenskapsspråket stemmer noen ganger ikke overens med den virkelige verden. Når du kjenner de fire verdiene i ligningen C1V1 = C2V2, gjør fortynningen som følger:
- Mål volumet V1 fra en løsning med en konsentrasjon av C1. Tilsett deretter tilstrekkelig fortynningsmiddel (vann, etc.) for å gjøre det totale volumet V2. Denne nye løsningen vil ha den konsentrasjonen du ønsker (C2).
- I eksempelet vårt, for eksempel, måler vi først 0,2 ml av en 5 M. løsning. Deretter vil vi legge til nok vann til å øke løsningens volum til 1 L: 1 L - 0,0002 L = 0,9998 L, eller 999, 8 ml. Med andre ord vil vi tilsette 999,8 ml vann til vår lille prøveløsning. Vår nye, fortynnede løsning har en konsentrasjon på 1 mM, som er vår ønskede konsentrasjon.
Metode 2 av 2: Lag en enkel og praktisk fortynningsløsning

Trinn 1. Les eventuell emballasje for informasjon
Det er en rekke årsaker til at du kanskje vil lage en fortynningsløsning hjemme, på kjøkkenet eller i et annet ikke-kjemisk laboratorium. For eksempel er det en fortynning å lage appelsinjuice av et enkelt konsentrat. I mange tilfeller inneholder produktet som må fortynnes informasjon om fortynningen som må gjøres, et sted på emballasjen. De kan ha presise instruksjoner å følge. Her er noen ting du bør se etter når du leter etter informasjon:
- Produktvolum brukt
- Volum av fortynningsmiddel brukt
- Type fortynningsmiddel som brukes (vanligvis vann)
- Spesielle blandingsinstruksjoner
- Du kan ikke se informasjon om den eksakte konsentrasjonen av væsken som brukes. Denne informasjonen er ikke nyttig for den gjennomsnittlige forbrukeren.

Trinn 2. Tilsett stoffet som fungerer som et fortynningsmiddel til den konsentrerte løsningen
For enkle husholdningsfortynninger, som de du kan lage på kjøkkenet, trenger du egentlig bare å vite volumet av konsentrat du bruker og den omtrentlige sluttkonsentrasjonen du vil ha før du starter. Fortynn konsentratet med en passende mengde fortynningsmiddel, som bestemmes avhengig av volumet av det opprinnelige konsentratet som ble brukt. Se nedenfor:
- For eksempel, hvis vi ønsket å fortynne 1 kopp appelsinjuice -konsentrat til 1/4 av sin opprinnelige konsentrasjon, ville vi legge til 3 kopper vann inn i konsentratet. Vår siste blanding vil ha 1 kopp konsentrat i 4 kopper hel væske - 1/4 av den opprinnelige konsentrasjonen.
- Her er et mer komplisert eksempel: Hvis vi ønsket å fortynne 2/3 kopp konsentrat til 1/4 av sin opprinnelige konsentrasjon, ville vi legge til 2 kopper vann, fordi 2/3 kopp tilsvarer 1/4 ganger 2 og 2/3 kopp av hel væske.
- Sørg for å legge stoffet i en beholder som er stor nok til å holde det siste volumet du vil ha - en stor bolle eller lignende beholder.

Trinn 3. Ignorer pulvervolumet i de fleste tilfeller
Tilsetning av et pulver (for eksempel visse drikkeblandinger) til en væske anses vanligvis ikke som en fortynning. Volumendringen som følge av tilsetning av en liten mengde pulver til væsken er vanligvis liten nok til å være ubetydelig. Med andre ord, når du tilfører en liten mengde pulver til en væske, tilsett bare pulveret til ønsket sluttvolum av væske og bland.
Advarsel
- Følg eventuelle sikkerhetsretningslinjer gitt av produsenten eller påkrevd av din bedrift. Dette er spesielt viktig hvis du må fortynne syreoppløsningen.
- Arbeid med sure løsninger kan kreve mer detaljerte sikkerhetstiltak og retningslinjer enn med ikke-sure løsninger.






